1. FUNDAMENTO
El cristal violeta (colorante catiónico) penetra en
todas las células bacterianas (tanto grampositivas como gramnegativas) a través
de la pared bacteriana. El lugol (I2) actúa de mordiente,
haciendo que el cristal violeta se fije con mayor intensidad a la pared de la
célula bacteriana. El I2 entra en las células y forma un complejo
insoluble en solución acuosa con el cristal violeta.
La
mezcla de alcohol-acetona que se agrega, sirve para realizar la decoloración, ya
que en la misma es soluble el complejo I2/cristal violeta. Los
organismos grampositivos no se decoloran, mientras que los gramnegativos sí lo
hacen.
Para
poner de manifiesto las células gramnegativas se utiliza una coloración de
contraste. Habitualmente es un colorante de color rojo, como la safranina o la fucsina. Después de la coloración de
contraste las células gramnegativas son rojas, mientras que las grampositivas
permanecen violetas.
2. OBJETIVO
Es un procedimiento rápido que proporciona la misma información que
una tinción simple en cuanto a morfología, tamaño y agrupamiento de las
bacterias, pero además divide a las bacterias según el color del que se tiñen
en grampositivas de color azul o violeta oscuro y gramnegativas de rosa
intenso.
3. MATERIAL Y REACTIVOS
Portaobjetos,
pipetas Pasteur, soporte para portas, muestra de siembra de bacterias, asa de
siembra y mechero bunsen.
Suero
fisiológico estéril, cristal violeta, lugol, alcohol/acetona proporción 1:1 y
safranina.
4. PROTOCOLO
·
Operaciones
Para preparar 250 ml de Alcohol/acetona en
proporción 1:1 necesitamos alcohol al 70 % y acetona al 30% y el alcohol lo
tenemos al 96% por lo que realizamos los siguientes cálculos.
Co x Vo = Cf x Vf
96 x Vo = 70 x 250 Vo = 182´29ml de
alcohol. 250- 182´29 = 67´71 ml de
acetona.
1. Poner en el porta una gota de suero fisiológico
estéril y mezclar con el inóculo para hacer la extensión de la muestra.


2. Fijamos la extensión con calor, pasando el porta
por encima de la llama, con cuidado de no quemar el porta.

3. Cubrir la extensión con cristal violeta durante 1 min, después decantar y lavar con agua de grifo los restos que queden.
4. Cubrir la extensión con lugol (mordiente)
durante 1 min, después decantar y lavar con agua de grifo.
5. Cubrir la extensión con la mezcla de
alcohol/acetona en proporción 1:1 durante 30 s, después decantar y lavar con
agua de grifo.
6. Cubrir la extensión safranina (coloración
de contraste) durante 2 min, después decantar y lavar con agua de grifo.
7. Dejar secar.
8. Visualizar al microscopio óptico.
5. MEDIDAS DE SEGURIDAD
1.
Es imprescindible uso de bata de laboratorio y guantes desechables.
2.
La zona de trabajo debe estar siempre limpio y ordenado.
3.
Los microorganismos deben manejarse siempre alrededor de la llama.
4. Cuando
se manipulan microorganismos hay que evitar llevarse las manos a la boca, nariz,
ojos, etc., por nuestra propia seguridad.
5.
Desechar el material contaminado en los recipientes adecuados, que serán
esterilizados posteriormente.
6.
Prohibido sacar muestras contaminadas del laboratorio.
7.
Extremar la precaución con el encendido del mechero Bunsen y su manipulación.
6. RESULTADO
Esta
foto pertenece a la bacteria 3 y cómo podemos apreciar es Gram positiva ya que
los bacilos son de color violeta oscuro. Muchos bacilos se unen por los
extremos por lo que es del género Bacillus.
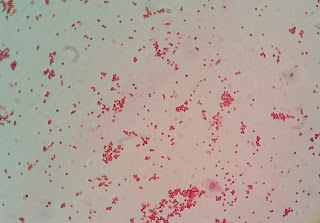
Esta foto es de muestra bucal sembrada en placa con agar nutritivo, observamos que los puntos son cocos que son de color rojo aunque deberían estar de color violeta (Gram positivos) porque la tinción no está hecha correctamente y los puntos negros son levaduras. Los cocos se agrupan en racimos por lo que la especie es del genero Staphylococcus.


No hay comentarios:
Publicar un comentario